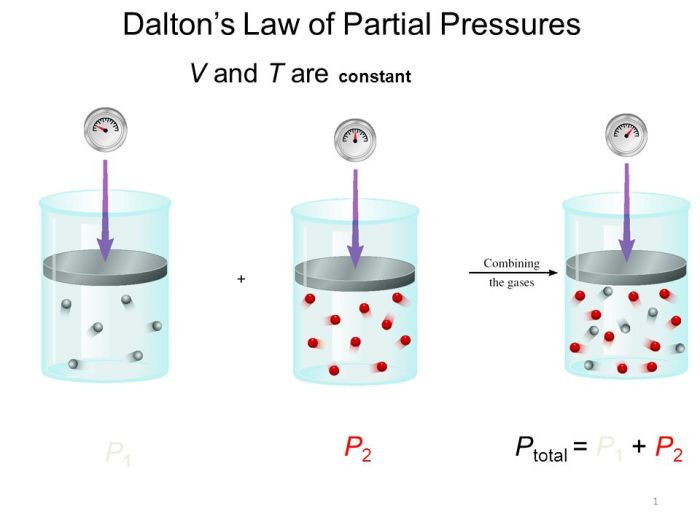
Dalton’s Law of Partial Pressure Worksheet Answers: Dive into the realm of gas mixtures and partial pressures with our comprehensive guide. This resource unveils the intricacies of Dalton’s Law, empowering you to confidently navigate worksheet problems and grasp its diverse applications.
Dalton’s Law of Partial Pressures, a cornerstone in the study of gases, provides a profound understanding of how individual gas components contribute to the overall pressure of a mixture. Through this guide, we unravel the intricacies of this law, offering a structured approach to solving worksheet problems and illuminating its significance in various scientific fields.
Dalton’s Law of Partial Pressures: Dalton’s Law Of Partial Pressure Worksheet Answers
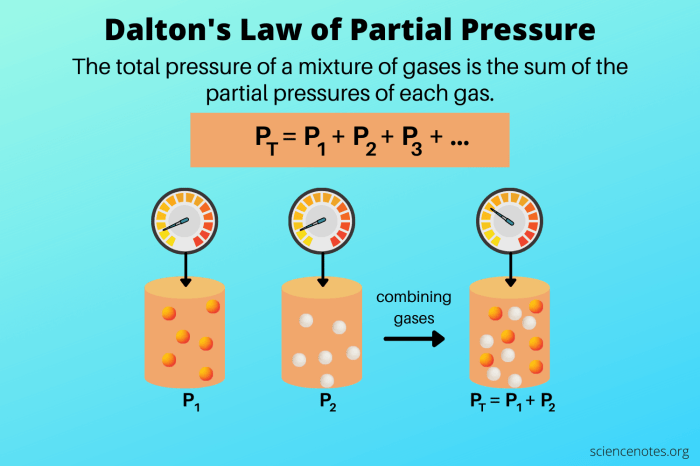
Dalton’s Law of Partial Pressures adalah hukum gas yang menyatakan bahwa tekanan total campuran gas sama dengan jumlah tekanan parsial masing-masing gas dalam campuran. Tekanan parsial suatu gas adalah tekanan yang akan diberikan oleh gas tersebut jika menempati volume campuran sendirian pada suhu yang sama.
Secara matematis, hukum Dalton dapat dinyatakan sebagai berikut:
Ptotal= P 1+ P 2+ … + P n
di mana:
- P totaladalah tekanan total campuran gas
- P 1, P 2, …, P nadalah tekanan parsial masing-masing gas dalam campuran
Hukum Dalton memiliki banyak aplikasi dalam berbagai bidang, termasuk meteorologi, penyelaman, dan anestesi.
Worksheet Answers, Dalton’s law of partial pressure worksheet answers
Soal: Sebuah wadah berisi campuran gas nitrogen (N 2) dan oksigen (O 2). Tekanan parsial nitrogen adalah 300 mmHg dan tekanan parsial oksigen adalah 200 mmHg. Berapakah tekanan total campuran gas tersebut?
Penyelesaian:
- Tentukan tekanan total menggunakan Hukum Dalton:
- Substitusikan tekanan parsial yang diberikan:
- Hitung tekanan total:
Ptotal= P N2+ P O2
Ptotal= 300 mmHg + 200 mmHg
Ptotal= 500 mmHg
Jadi, tekanan total campuran gas adalah 500 mmHg.
Signifikansi:
Jawaban ini menunjukkan bahwa tekanan total campuran gas sama dengan jumlah tekanan parsial masing-masing gas dalam campuran, yang sesuai dengan Hukum Dalton.
Applications of Dalton’s Law
Hukum Dalton memiliki berbagai aplikasi di berbagai bidang, antara lain:
- Meteorologi:Hukum Dalton digunakan untuk memprediksi tekanan atmosfer dan perubahan cuaca. Tekanan atmosfer adalah tekanan total campuran gas di atmosfer bumi, yang terdiri dari nitrogen, oksigen, dan gas lainnya.
- Penyelaman:Hukum Dalton digunakan untuk menghitung tekanan parsial gas dalam campuran pernapasan penyelam. Penyelam perlu mengetahui tekanan parsial oksigen dan nitrogen dalam campuran pernapasan mereka untuk menghindari efek buruk seperti keracunan oksigen dan penyakit dekompresi.
- Anestesi:Hukum Dalton digunakan untuk menentukan konsentrasi gas anestesi dalam campuran pernapasan pasien. Anestesi bekerja dengan menekan sistem saraf pusat, dan konsentrasi gas anestesi dalam campuran pernapasan harus dikontrol dengan cermat untuk memastikan anestesi yang aman dan efektif.
Limitations of Dalton’s Law
Hukum Dalton memiliki beberapa keterbatasan, antara lain:
- Gas tidak berinteraksi:Hukum Dalton hanya berlaku untuk gas yang tidak berinteraksi satu sama lain. Jika gas dalam campuran bereaksi satu sama lain, tekanan total campuran mungkin tidak sama dengan jumlah tekanan parsial masing-masing gas.
- Suhu tinggi dan tekanan tinggi:Hukum Dalton mungkin tidak akurat pada suhu dan tekanan yang sangat tinggi. Pada kondisi ini, molekul gas dapat saling berinteraksi dan perilaku gas dapat menyimpang dari perilaku ideal.
Dalam situasi di mana keterbatasan ini berlaku, persamaan yang lebih kompleks, seperti persamaan virial, harus digunakan untuk menghitung tekanan total campuran gas.
FAQ Explained
What is the significance of Dalton’s Law of Partial Pressures?
Dalton’s Law provides a crucial framework for understanding the behavior of gas mixtures, enabling the calculation of total pressure and partial pressures of individual gas components.
How can I use Dalton’s Law to solve worksheet problems?
To solve worksheet problems using Dalton’s Law, identify the partial pressures of each gas component and apply the formula: Total Pressure = Sum of Partial Pressures.
What are the limitations of Dalton’s Law?
Dalton’s Law assumes ideal gas behavior and does not account for interactions between gas molecules. It may not be applicable in situations involving highly non-ideal gases or extreme conditions.